Le cellule staminali: dalla ricerca all'applicazione clinica
L. Gianaroli, P. Carai, I. Stanghellini, A.P. Ferraretti, M.C. Magli
Staminalità e Plasticità: la tradizione
Le cellule staminali vengono considerate le unità organizzative responsabili dello sviluppo e della rigenerazione di tessuti e organi. Convenzionalmente sono definite cellule clonogeniche, ovvero cellule in grado sia di proliferare autonomamente, sia di differenziarsi in varie popolazioni cellulari. Secondo le teorie più tradizionali possono essere suddivise in un gruppo “a lungo termine”, capace di replicarsi infinitamente ed in uno “a breve termine”, capace di proliferare solo per un periodo limitato (Weissman, 2000). Caratteristica peculiare della cellula staminale è la divisione ineguale, che consiste nella formazione di due cellule figlie di cui una ricoprirà il ruolo di staminale mentre l’altra, progredendo nel processo di sviluppo, assumerà il ruolo di progenitrice o precursore, perdendo progressivamente la capacità di proliferare (Cedar et al., 2007). Quest’ultima è in grado di moltiplicarsi e differenziarsi in un numero limitato di fenotipi cellulari che a loro volta danno origine ad una progenie costituita da cellule dal potenziale differenziativo ridotto, fino alla formazione di cellule differenziate mature (Weissman, 2000). Le cellule staminali possiedono il ruolo chiave di mantenere l’omeostasi in tessuti quali, ad esempio, sangue ed epidermide che si rinnovano per l'intera durata della vita di un individuo.
La cellula totipotente per eccellenza, capace di formare un organismo in toto (a livello embrionale, fetale ed adulto), è lo Zigote. La possibilità di dare origine ad un organismo in toto permane, nell'uomo, per tre divisioni cellulari, ovvero finché l’embrione non raggiunge lo stadio di otto cellule, a partire dal quale i singoli blastomeri riducono il proprio potenziale differenziativo. Negli stadi embrionali successivi, morula e blastocisti, le cellule sono altamente plastiche e mantengono la capacità di formare vari sottotipi cellulari. In particolare, la blastocisti assume un ruolo fondamentale nel campo della ricerca delle cellule staminali embrionali (ESCs) e della medicina rigenerativa, in quanto dalla sua componente definita Inner Cell Mass (ICM) sono comunemente isolate le ESCs, che possono essere utilizzate, successivamente, per la derivazione in vitro di vari tessuti di rilevanza clinica. La massa cellulare interna (ICM), in vivo, dà origine all’individuo mentre il trofoblasto, la seconda componente della blastocisti, porta alla formazione dei tessuti extraembrionali. L’ICM è, a sua volta, costituita da un gruppo eterogeneo di cellule divisibile in due sotto-popolazioni: le cellule Progenitrici dell’Epiblasto (P-EPI) e le cellule Progenitrici dell’Endoderma Extraembrionale (P-EnEx). Benché siano morfologicamente indistinguibili, le P-EPI e le P-EnEx esprimono marcatori molecolari diversi. In particolare, nelle P-EPI prevale l’espressione di POU5F1 (meglio noto come OCT4) e NANOG, noti fattori di trascrizione coinvolti nello sviluppo embrionale, mentre nelle cellule P-EnEx prevalgono i fattori coinvolti nello sviluppo dei tessuti extraembrionali, quali CDX2 e GATA6 (Binas, 2009) (Figura 1).
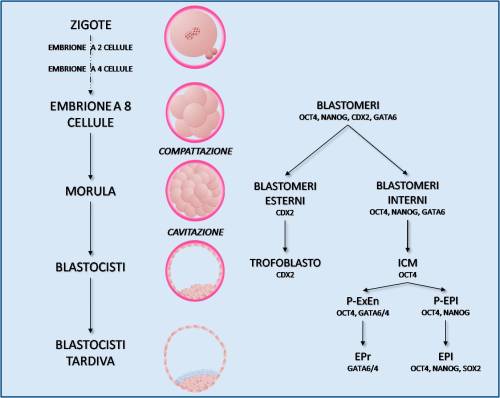
Allo stadio di blastocisti tardiva, le P-EnEx migrano verso la cavità interna, o Blastocele, dando inizio al processo di differenziamento in Endoderma Primitivo (EPr). Successivamente all’impianto, l’EPr darà origine al parenchima del sacco vitellino (membrana esterna all'embrione, costituito dall'Endoderma Extraembrionale, EnEx) che, nelle prime fasi della gestazione, ha una funzione emopoietica mentre, successivamente, verrà riassorbito nell'intestino primitivo del futuro feto. Le cellule dell’ICM non interessate a questo processo di migrazione (ora definite cellule dell’epiblasto o EPI) attivano un programma di espressione genica che si tradurrà, dopo l’impianto, in una massiva proliferazione ed epitelizzazione. Fino al termine di questa fase, le cellule che compongono l’epiblasto sono pluripotenti, ovvero capaci di dare origine a tutti i compartimenti cellulari dell'organismo adulto, ma non all’organismo in toto, ed esprimono un set ricorrente di fattori di trascrizione definiti di “pluripotenza” di cui OCT4 è uno dei membri più conosciuti. Al termine di questa serie di trasformazioni le cellule EPI danno origine al feto, all’Amnion (il lato interno della membrana che lo ricopre durante la gravidanza) e al Mesoderma extraembrionale (il tessuto connettivo lasso che circonda completamente amnion e sacco vitellino) (Binas, 2009).
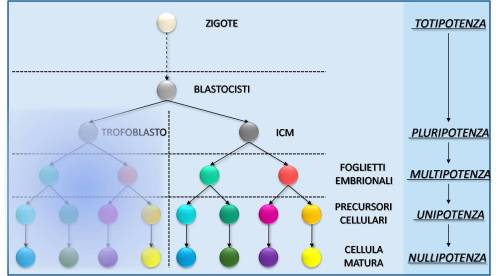
Con la progressione dello sviluppo ogni tessuto acquisisce, secondo le teorie più tradizionali, la propria cellula staminale somatica. Tale cellula è considerata multipotente in quanto è capace di generare, differenziandosi, le cellule dello specifico compartimento in cui risiede come, ad esempio, le cellule staminali emopoietiche che possono dare origine a qualsiasi elemento cellulare presente nel sangue. Tra le cellule risultanti da tale passaggio esistono altre cellule staminali dal potenziale ridotto, definite unipotenti, che possono differenziarsi terminalmente in un solo elemento cellulare (ad esempio gli osteoblasti possono differenziarsi solo in osteociti). La cellula matura che ne deriva è definita nullipotente (Cedar et al., 2007) (Figura 2).
Le cellule Staminali Embrionali Umane
Le cellule Staminali Embrionali Umane (human Embryonic Stem Cells o hESCs) furono descritte per la prima volta nel 1998 dopo essere state isolate dalle masse cellulari interne di blastocisti umane, donate a scopi di ricerca. Tali cellule sono state caratterizzate, in vivo, attraverso la formazione di teratomi e, in vitro, attraverso l’analisi di espressione di marcatori specifici (ma non univoci) e saggi sia enzimatici sia di differenziamento. Diversamente dai modelli animali, per quanto riguarda le hESCs non è possibile, per ragioni etiche, eseguire studi di chimerismo e trasmissione alla linea germinale. Ad oggi è ormai assodato che le cellule staminali (sia umane sia murine) abbiano la capacità di replicarsi infinitamente in vitro, sebbene esistano differenze sia a livello dell'espressione genica sia a livello dei fattori necessari per la crescita in vitro (es: l’impiego del Leukaemia Inhibitory Factor – LIF - indispensabile per le staminali murine, non è invece necessario per quelle umane).
E' necessario, tuttavia, sottolineare che la mancanza di saggi di sviluppo in vivo per le hESCs non permette un paragone diretto con la controparte murina: le differenze esistenti tra le due popolazioni cellulari sono, presumibilmente, attribuibili allo stadio di sviluppo in cui tali cellule si trovano piuttosto che a caratteristiche specie-specifiche. Diversi studi, infatti, pongono l’origine delle ESCs umane nell’Epiblasto (EPI), mentre quelle murine sembrano derivare dalle popolazioni cellulari antecedenti a questo stadio di sviluppo (P-EPI) (Binas, 2009).
Le caratteristiche, ad oggi considerate-chiave, nel campo delle cellule staminali sono rappresentate da:
1.
Divisioni asimmetriche con la formazione di cellule figlie staminali (auto-rinnovamento o self renewal) e di cellule figlie dal potenziale differenziativo ridotto, che si replicano transitoriamente (destinate a differenziarsi dopo un numero specifico di divisioni);
- La persistenza della capacità replicativa per l’intera vita dell’individuo;
- Il mantenimento delle cellule staminali grazie alla presenza di un microambiente specifico (stem cell niche) formato da altre cellule.
A fronte di tali considerazioni (Slack, 2008) l’embrione pre-impianto non contiene cellule staminali in senso stretto, in quanto tutte le cellule che lo compongono si differenziano rapidamente nei tre foglietti germinali: ectoderma, mesoderma ed endoderma. Tali cellule, inclusi i precursori delle cellule staminali embrionali, sono pertanto definite “cellule progenitrici”. Sebbene tale termine sia stato definito meno chiaramente, esso implica che la cellula
possa proseguire verso uno stato di proliferazione transiente al termine del quale è destinata a differenziarsi in uno o più fenotipi specifici (Slack, 2008).
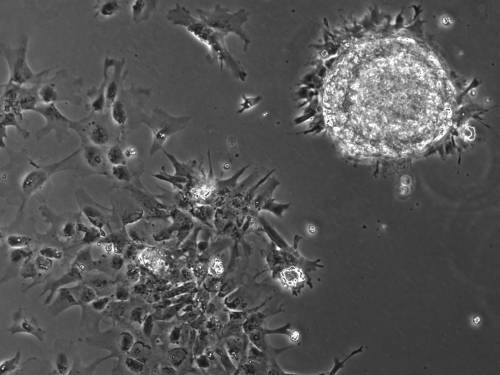
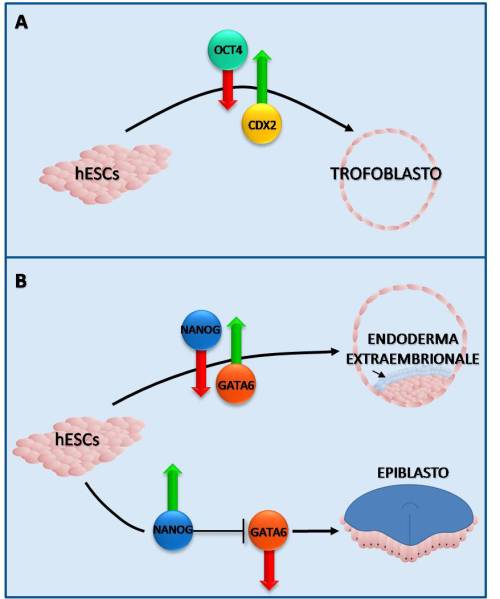
Per quanto riguarda il potenziale differenziativo le hESCs, a differenza dei blastomeri, non contribuiscono efficacemente a tutti i tessuti se iniettate all’interno di una morula o di una blastocisti. Tali cellule possono tuttavia formare, in vitro, i Corpi Embrioidi (o Embryoid Bodies, EBs) (Figura 3) e differenziarsi in tutti i lineages dell’organismo (processo che non avviene in vivo); in tal senso è possibile affermare che le hESC mantengano una stretta relazione con i blastomeri dei primi stadi embrionali. Analogamente ai blastomeri, le hESCs sono regolate da meccanismi di attivazione e repressione di fattori di trascrizione specifici, che consentono a tali cellule di azzerare “facilmente” il proprio commitment in senso epiblastico in risposta a precisi stimoli esterni. Per citare alcuni esempi il contemporaneo aumento nell’espressione di CDX2 e la riduzione di OCT4 inducono le hESCs a differenziarsi in cellule trofoectodermiche ed, analogamente, la riduzione dell’espressione di NANOG e l’aumento di GATA-6 (o di GATA-4, gene coinvolto nello sviluppo pre- e post-impianto, nello sviluppo del sistema cardiovascolare e delle gonadi) possono convertire le hESCs in cellule EnEx (fenomeno che avviene anche durante il differenziamento in EBs). Con lo stesso meccanismo, ma in direzione opposta, un incremento nell’espressione di NANOG può, attraverso il legame al promotore, sopprimere l’espressione di GATA-6 impedendone la trascrizione e promuovendo la formazione dell’epiblasto (Binas, 2009) (Figura 4).
Tenendo conto di tali considerazioni, le hESCs, sebbene originino da uno stadio embrionale successivo ai blastomeri, sembrano mantenerne la tipica capacità regolatoria in quanto possiedono uno stato epigenetico “unico”, caratterizzato da una conformazione cromatinica aperta che presumibilmente ne determina la flessibilità fenotipica.
Cellule Staminali nell’Organogenesi
La visione convenzionale dello sviluppo embrionale, inteso come serie di processi differenziativi gerarchicamente organizzati, è generalmente accettata nel campo della ricerca sulle cellule staminali. Per ogni passaggio differenziativo l’espressione di una particolare combinazione di fattori di trascrizione è attivata o repressa in risposta ad uno specifico segnale extracellulare originabile da una o più molecole, definite “fattori di induzione” (Slack, 2008). Ogni fase del processo differenziativo può condurre a molteplici percorsi di specificazione cellulare. Concentrazioni diverse di tali fattori provocano, infatti, l’attivazione o la repressione dell’espressione genica di specifici fattori di trascrizione e conseguentemente un percorso differenziativo definito. La ripetizione di questo meccanismo consente all’embrione pre-impianto di sviluppare autonomamente un organismo composto da una complessa combinazione di strutture cellulari. Risulta chiaro, quindi, come alcuni tessuti possano derivare da più di un abbozzo embrionale e che in realtà esistano molteplici percorsi di sviluppo, dalla cellula progenitrice fino alla cellula fenotipicamente matura, come esemplificato dallo sviluppo embrionale del pancreas. Nei mammiferi, infatti, tale organo origina da due abbozzi endodermici caratterizzati, inizialmente, da profili d’espressione molto diversi, ma che, una volta differenziati terminalmente, risultano molto simili (Slack, 2008).
In questo contesto è stato ipotizzato che cellule staminali tessuto-specifiche possano rimanere ad un livello di specializzazione simile a quello dell’abbozzo embrionale che le ha generate. Per confermare tale ipotesi, tuttavia, sarà necessaria una dettagliata analisi comparativa dei profili di espressione tra popolazioni cellulari pure, derivate sia dagli abbozzi embrionali, sia dalle corrispettive cellule staminali tessuto-specifiche. Numerosi studi sul topo, inoltre, indicano che i fattori di trascrizione chiave nello sviluppo di un organo o di un tessuto sono essenziali per la formazione dell’abbozzo embrionale che lo ha generato e per il mantenimento della popolazione staminale che ne risulta (Slack, 2008). Alcuni esempi di tale fenomeno sono rappresentati da SOX2, fattore di trascrizione che determina le proprietà del neuroectoderma a livello embrionale e delle staminali neurali a livello post-natale e RUNX1, fattore necessario sia per la formazione iniziale del tessuto emopoietico nell’aorta dorsale, sia nel mantenimento delle cellule staminali emopoietiche adulte. Esistono, tuttavia, anche situazioni diametralmente opposte, come nel caso dello sviluppo dell’ipofisi anteriore: in questo caso una popolazione cellulare esprimente nestina (marcatore delle cellule staminali neurali) deriva in modo indipendente dai corrispettivi progenitori embrionali ed esprime un profilo trascrizionale differente, confermando l’ipotesi per cui lo stesso tipo di cellula differenziata può originare da differenti pathways di sviluppo embrionale. Infine, esistono tessuti (come cuore, tessuto adiposo e porzioni di tessuto connettivo) che presentano, nella vita post-natale, un ciclo di rinnovamento lento e che presumibilmente non possiedono una “reale” popolazione di cellule staminali (Slack, 2008).
Cellule Staminali nell’adulto
Parallelamente alla visione più convenzionale dello sviluppo embrionale ne esiste una contrapposta in cui tutti o la maggior parte dei tessuti sono continuamente rinnovati. Secondo tale teoria, la fonte cellulare di questo processo è rappresentata da una o più popolazioni di cellule staminali pluripotenti, localizzate nel midollo osseo o in altra sede, che possono entrare nella circolazione sanguigna e differenziarsi in vari lineages a seconda dell’ambiente cellulare circostante o niche. Al momento si presume che la niche staminale sia presente in diversi tessuti tra cui il midollo osseo, il cervello, il fegato, l’epidermide, i muscoli scheletrici, il tratto gastrointestinale, il pancreas, gli occhi, il sangue e la polpa dentale (Hipp et al., 2008). Tale speculazione si basa sull’ipotesi che esistano cellule staminali pluripotenti in tutto il corpo e che il concetto di staminalità si debba concentrare maggiormente sulla plasticità piuttosto che sul potenziale replicativo a lungo termine.
Nell’articolo di Shah (Shah et al., 1996) si ipotizza che le cellule staminali pluripotenti, a livello post-natale, originino dalla Cresta Neurale, porzione dell’embrione che si ritiene vada incontro ad un tipo di differenziamento maggiormente stocastico (cellule, pur fisicamente vicine, si differenziano in tempi e in lineages diversi) rispetto ai propri progenitori cellulari. Nello stesso lavoro si ipotizza che possa esistere una sorta di “residuo embrionale” formato da cellule pluripotenti sviluppatesi negli stadi di sviluppo iniziali, definite anche “cellule staminali della cresta neurale” dalle quali ne è stato documentato il differenziamento in tessuti quali nervoso, epiteliale, cardiaco e cutaneo. Appare evidente, quindi, che esistono numerose cellule “pluripotenti” in tale regione, prima dell’inizio della migrazione cellulare. Durante tale processo, il loro numero e grado di “pluripotenza” si riduce, pur mantenendo un minimo grado di plasticità e, fisiologicamente, si differenziano come risultato dell’esposizione a fattori di induzione (Shah et al., 1996). E’ stato, inoltre, dimostrato che almeno due tipi cellulari, rilevanti a livello clinico, hanno questa origine e sono rappresentate dalle Skin Precursor Cells (SPCs) e dalle Mesenchymal Stem Cells (MSCs) del midollo osseo. Queste ultime, storicamente isolate dallo stroma del midollo osseo, oggi possono essere indotte a migrare nella circolazione sistemica attraverso la somministrazione di fattori di crescita emopoietici, quali GM-CSF (Granulocyte Macrophage Colony Stimulating Factor), G-CSF (Granulocyte Colony Stimulating Factor) e SCF (Stem Cell Factor). Di tali cellule è stata dimostrata la capacità di differenziarsi in numerosi fenotipi in vitro e, quando iniettate in blastocisti, di contribuire alla formazione di molteplici tessuti quali sistema nervoso, tessuto adiposo, muscolare ed a diversi organi, quali fegato, polmoni, milza e intestino (Shah et al., 1996).
In un altro lavoro è stato riportato, invece, l’isolamento, da un individuo adulto, di cellule umane pluripotenti che presentano un potenziale di sviluppo maggiore delle cellule staminali tessuto-specifiche, tanto da avvicinarsi alle capacità differenziative delle hESCs (Pittenger et al., 1999). Tra le popolazioni cellulari descritte, le Mesenchymal Adult Progenitor Cells (MAPCs) presentano una capacità proliferativa senza limiti e la capacità di differenziarsi nella maggior parte dei fenotipi cellulari conosciuti. Questo tipo di cellule non è, tuttavia, molto rappresentato all’interno del tessuto d’interesse, se ne stima una frequenza di una cellula ogni 105 circa. In modo simile, cellule staminali pluripotenti (Pluripotent Stem Cells - PSCs) sono state isolate, nel topo, da diversi tessuti e ne è stata riportata la capacità di differenziarsi in tessuto muscolare, neuronale e adiposo in specifiche condizioni colturali.
Nel 2006 ha destato scalpore l’articolo riguardante la derivazione delle Induced Pluripotent Stem Cells (iPSCs) da fibroblasti murini (Takahashi and Yamanaka, 2006). Tali cellule, attraverso la trasfezione di specifici fattori di trascrizione (oct4, nanog, sox2, c-myc), sono state riprogrammate ad uno stato simile a quello di ESCs (da cui il nome “cellule staminali indotte”) con un’efficienza variabile da 1/100 a 1/1000000. A fronte di un evento così raro è sorto l’interrogativo se cellule umane adulte potessero, spontaneamente, de-differenziare, in coltura, in cellule staminali pluripotenti e se quindi le cellule staminali adulte pluripotenti non derivino in realtà da artefatti colturali. Le iPSCs saranno trattate con maggiori dettagli in una sezione successiva.
E’ stato inoltre ipotizzato che alcune cellule dell’epiblasto possano persistere oltre l’inizio della gastrulazione e permanere in uno stato ESC-simile. Tali elementi cellulari potrebbero essere incorporate nell’amnion o all’interno dell’endoderma extraembrionale e, successivamente, ritornare alla circolazione sistemica e quindi all’embrione (evento, in ogni caso, raro), come nel caso delle cellule staminali del liquido amniotico (Amniotic Fluid-Derived Stem Cells - AFS) (Hipp et al., 2008). Tale meccanismo potrebbe spiegare alcune tra le proprietà delle cellule staminali pluripotenti post-natali: la difficoltà nell’isolamento (acuita dall’età del donatore) e la minore potenzialità differenziativa delle ESCs (Slack, 2008).
Una possibile critica a questa visione si basa sulla distribuzione anatomica dei tumori delle cellule germinali (inclusi i teratomi), che potrebbero derivare da cellule pluripotenti poste in sedi ectopiche, sebbene si localizzino principalmente a livello gonadico. Esistono, in ogni caso, tumori delle cellule germinali che si originano nel cervello (in particolare nelle regioni pineale e neuroipofisaria) e che non possono essere spiegati facilmente come originati da Primordial Germ Cells (PGCs) (Slack, 2008).
Cellule Germinali Primordiali (PGCs) e Cellule Germinali Embrionali (EGCs)
Le Cellule Germinali Primordiali (PGCs) sono cellule diploidi che si formano, a livello embrionale, durante la Gastrulazione a partire dalla porzione prossimale dell’epiblasto. Le PCGs, fisiologicamente, migrano attraverso segnali chemotattici (ad es. chemochina SDF-1) dalla loro posizione originale, in prossimità del sacco vitellino, alla Cresta Genitale, porzione dell’embrione che darà origine alle gonadi. Al termine di questo processo, le cellule germinali vanno incontro a diversi cambiamenti sia morfologici (come la contrazione citoplasmatica) sia di espressione genica (ad es. attivazione del Dead Box Transcription Factor o DDX4). Le PGCs sono caratterizzate dall’attivazione della famiglia delle Bone Morphogenetic Proteins - BMPs - (in particolare BMP4 e BMP8b) e dall’espressione di OCT4 che, coadiuvata dall’attivazione del sistema c-KIT / SCF da parte delle cellule della niche, ne mantiene la capacità proliferativa (Turnpenny et al., 2006).
Le cellule germinali primordiali presentano alcune similarità con le P-EPI e, se coltivate in vitro, danno origine alle Cellule Germinali Embrionali (EGCs). Sebbene tecnicamente difficoltoso, quest’ultime possono essere derivate da materiale fetale (di origine abortiva) di età gestazionale variabile dalla quinta alla nona settimana e coltivate in presenza di Forskolina (fattore di crescita che aumenta i livelli intracellulari di cAMP e stimola la mitosi), FGF2 (fattore di crescita appartenente alla famiglia dei Fybroblast Growth Factors, dotato di attività mitogena, angiogenica e neurotrofica ad ampio spettro), LIF e SCF. Tali fattori di crescita sono garantiti, in vivo, dal contatto con specifiche cellule somatiche localizzate nella niche, rappresentate dalle cellule del Sertoli nel maschio e dalle cellule della granulosa nella femmina. La perdita di questi fattori paracrini determina un effetto nocivo sulle EGCs e ne inibisce la proliferazione (Turnpenny et al., 2006).
Il mantenimento delle EGCs umane in uno stato indifferenziato e per periodi di coltura prolungati presenta alcune difficoltà a livello laboratoristico: nel tempo la popolazione cellulare positiva per i marcatori di pluripotenza (ad es. OCT4 e i membri della famiglia degli antigeni embrionali stadio-specifici o SSEA) si riduce in particolar modo dopo cicli di congelamento/scongelamento (Turnpenny et al., 2006).
Altri marcatori caratteristici delle EGCs, oltre al ben noto OCT4, sono TERT (gene codificante l’enzima Telomerasi), SOX2, FGF4 (altro fattore di crescita appartenente alla famiglia del Fybroblast Growth Factor, legato al processo di proliferazione cellulare), DPPA3 (fattore di pluripotenza specifico della linea germinale) e IFITM1 (membro della famiglia di proteine indotte da interferone).
E’ stato dimostrato, in vitro, che le germinali embrionali presentano un profilo epigenetico corretto per quanto riguarda l’espressione monoallelica dei geni soggetti ad imprinting (caratteristica rilevante per un eventuale impiego clinico). Le EGCs, infine, possono dare origine a tutti i derivativi somatici (con una particolare propensione al differenziamento neurale) ed a gameti maturi, attraverso la formazione di corpi embrioidi (EBs). In vivo, al contrario, non ne è stata dimostrata, in modo inequivocabile, la capacità di formare teratomi (Turnpenny et al., 2006).
Induced Pluripotent Stem Cells (iPSCs)
Le Induced Pluripotent Stem Cells (iPSCs) sono definite cellule somatiche riprogrammate ad uno stato di pluripotenza e rappresentano una promettente fonte alternativa di cellule staminali paziente-specifiche. Le iPSCs, infatti, presentano problematiche di tipo etico ridotte, rispetto alle hESCs, in quanto non prevedono l’impiego di embrioni umani. Le iPSCs acquisiscono le caratteristiche di staminalità e pluripotenza attraverso la riprogrammazione (come menzionato precedentemente) allo stato di staminale embrionale, tramite l’introduzione di combinazioni di più fattori di pluripotenza. Questi ultimi possono essere classificati in tre diversi gruppi:
1) Fattori di trascrizione espressi dalle ESCs con funzioni note (es. OCT4, SOX2, NANOG, etc);
2) Fattori di crescita e/o oncogeni che sono coinvolti nella capacità replicativa delle ESCs (es. c-MYC, STAT3, ß-Catenina, etc);
3) Fattori di trascrizione espressi dalle ESCs con funzioni non note e/o poco chiare (es. ECAT1, ESG1, DNMT3L, GDF3, etc).
Le iPSCs umane esprimono marcatori delle hESCs tra cui gli antigeni embrionali stadio specifici SSEA3 e SSEA-4, marcatori di superficie quali TRA-1-60 e TRA-1-81 (appartenenti alla famiglia degli antigeni correlati ai cheratan-solfati e comunemente coinvolti nel riconoscimento delle cellule tumorali), NANOG, OCT4, SOX2 e fosfatasi alcalina (Takahashi et al., 2007). Le iPSCs presentano caratteristiche tipiche delle ESCs quali un’elevata attività telomerasica, patterns specifici di metilazione degli istoni e plasticità. Ciò è stato dimostrato sia in vitro, attraverso l’analisi dei corpi embrioidi e dai protocolli di differenziamento diretto, sia in vivo attraverso la formazione di teratomi.
L’aumento nell’espressione di OCT4 e SOX2 è sufficiente per attivare il processo di riprogrammazione in un fenotipo ES simile qualora tali fattori riescano a raggiungere i propri geni bersaglio. I quattro geni usati nel lavoro di Takahashi (Takahashi et al., 2007) comprendono, infatti, oltre a OCT4 e SOX2, KLF4 e c-MYC, che presumibilmente hanno l’abilità di rendere il genoma disponibile all’azione dei primi due.
La formazione delle iPSCs è comunque caratterizzata da una bassa efficienza, come osservato dalla bassa frequenza di riprogrammazione. La sua efficacia è, inoltre, dipendente dal grado di differenziamento e di accessibilità cromatinica della cellula originale, come dimostrato dall’aumento del numero di colonie riprogrammate in proporzione all’esposizione ai fattori di pluripotenza (Takahashi et al., 2007).
Sebbene le iPSCs possano, teoricamente, offrire innumerevoli potenzialità terapeutiche, l’applicazione delle metodiche di riprogrammazione in campo clinico è limitata dalla necessità di selezionare le cellule così riprogrammate. Questo processo può essere eseguito esclusivamente in vitro, mentre non è possibile formare iPSCs direttamente in vivo, restringendone, quindi, l’impiego a tecniche di trapianto.
Per un impiego futuro delle iPSCs in ambito clinico sarà necessario validarne il potenziale di crescita e di differenziamento e sviluppare nuove metodiche per il trasferimento dei fattori di riprogrammazione, al fine di ridurne l’eterogeneità d’espressione.
Staminalità e Plasticità: oggi
Recentemente diversi esperimenti hanno dimostrato che le cellule staminali adulte sono molto più plastiche di quanto fosse stato ipotizzato inizialmente e che possono differenziarsi nelle progenie di compartimenti cellulari diversi da quello cui appartengono (Alison et al., 2004).
In considerazione di tale evento è stato speculato che negli organismi adulti possa esistere un tipo di cellula staminale “universale”. Nel verificare tale ipotesi sono presenti, tuttavia, alcune difficoltà causate dalla mancanza di marcatori molecolari specifici e inequivocabili per le cellule staminali.
Se la cellula staminale è un’entità discreta dovrebbe esserne possibile, teoricamente, l’isolamento; tuttavia, anche all’interno di una popolazione di cellule staminali tessuto-specifiche, è presente un certo grado di eterogeneità, che ne complica ulteriormente l’identificazione e l’isolamento.
Tali complicazioni sono, inoltre, aumentate dalla grande eterogeneità dei tessuti, come nel caso del
Sistema Nervoso (Centrale e Periferico) e del tessuto muscolare, in cui anche il profilo di espressione genica non è omogeneo.
Da ciò si deduce che, all’interno di un tessuto eterogeneo, potrebbero essere presenti cellule staminali con diverso potenziale differenziativo e/o provenienti da altri tessuti, reclutate per agire come cellule progenitrici, pur possedendo profili di espressione differenti. Questo fenomeno non è specifico per un’unica popolazione cellulare ma potrebbe essere condiviso da diversi tessuti (Blau et al., 2001).
Così come la maggior parte delle cellule all’interno dell’organismo è in grado di adattarsi e modificarsi in risposta a stimoli specifici (es. iniziare il programma apoptotico in risposta a danno), allo stesso modo un meccanismo altrettanto condiviso potrebbe far si che varie cellule possano agire da cellule staminali. Da queste considerazioni emerge un concetto nuovo di staminalità, non più legato ad una gerarchia proliferativa/differenziativa ma di staminalità come funzione specifica acquisibile da diverse cellule dell’organismo. La dinamicità che caratterizza lo stato di cellula staminale ne rende possibile l’adattamento a diversi stimoli e percorsi differenziativi. Tale stato, così come si verifica per quello differenziato, deve essere mantenuto sia attraverso la continua attivazione di segnali intra- ed extracellulari tempo-specifici, sia attraverso l’”isolamento” da eventuali segnali extracellulari che ne possano indurre il differenziamento.
Queste osservazioni avvalorano la tesi secondo cui le cellule staminali adulte sono mantenute da una serie di molecole non ancora identificate in uno stato non-responsivo ai fattori di differenziamento. Esiste la possibilità, tuttavia, che non esista un reale compartimento di cellule staminali dedicate, e che, all’occorrenza, cellule impiegate nello svolgimento di altre funzioni possano convertirsi in staminali. Ne sono esempi le cellule progenitrici degli oligodendrociti (Oligodendrocyte Precursor Cells o OPCs) che, pur appartenendo ad un percorso differenziativo ben definito (solitamente danno origine ad astrociti, neuroni e cellule della glia, i tre lineages cellulari principali del sistema nervoso), in condizioni di coltura specifiche possono passare ad uno stato più plastico e, in modo simile, cellule muscolari striate multi-nucleate (quindi differenziate) o Miotubuli possono dare origine a cellule meno differenziate proliferanti, quali cellule muscolari mononucleate o Mioblasti), grazie alla sovrespressione del gene homeobox msx-1 o, dopo esposizione a fattori di differenziamento specifici, generare adipociti o condrociti (Blau et al., 2001).
Questi esempi dimostrano che anche le cellule differenziate (o comunque già legate ad uno specifico percorso differenziativo) possiedono un certo grado di plasticità che può indurle a convertirsi in cellule staminali-simili.
E’ stato proposto che il potenziale di staminalità di una cellula differenziata non sia necessariamente equivalente per ogni tipo cellulare e che la propensione ad acquisire caratteristiche di staminalità tende a diminuire con il processo di maturazione della cellula stessa.
In un contesto di danno o alterazione, tuttavia, stimoli provenienti dall’ambiente cellulare leso permetterebbero anche a cellule dotate di una bassa propensione alla staminalità di rigenerare i tessuti danneggiati. Gli ultimi dati suggeriscono, quindi, che la staminalità di una cellula adulta rappresenti una funzione regolabile, adattabile a diversi stimoli e non correlata ad una singola entità cellulare discreta (Slack, 2008).
Per tutte queste ragioni, nel panorama letterario, la definizione di staminalità sta progressivamente evolvendo verso un duplice concetto: stato di proliferazione a breve termine da un lato e stato funzionale, indipendente dalla capacità replicativa, dall’altro. Rimane, in generale, poco chiaro quanti stati cellulari di self-renewal non hanno controparti in vivo che possano essere ottenuti attraverso semplice manipolazione ambientale (substrati e/o fattori di crescita) e quanti stati cellulari di pluripotenza, in vivo, possano essere coltivati infinitamente.
Aspetti Clinici
Ad oggi la ricerca sulle cellule staminali non ha ancora raggiunto un’applicazione di routine in ambito clinico, in quanto devono ancora essere stabiliti molti criteri che tali cellule devono soddisfare prima di tale uso.
I tre maggiori approcci che si stanno sviluppando per raggiungere tali scopi sono:
1. Trapianto di cellule staminali o loro derivati cellulari;
2. Costruzione di tessuti biologici in vitro per impianto diretto con cellule staminali o loro derivati cellulari;
3. Induzione o miglioramento della proliferazione e differenziamento in vivo delle cellule staminali residenti per la rigenerazione del tessuto leso.
In termini di capacità proliferativa, una cellula staminale deve poter essere mantenuta in coltura illimitatamente in uno stato indifferenziato e deve essere in grado di formare cellule staminali identiche, mantenendo un fenotipo e un cariotipo fisiologici. Le cellule trapiantate devono, inoltre, sopravvivere all’impianto, integrarsi nell’ospite e determinarne un miglioramento funzionale (Carpenter et al., 2004).
Ad oggi la ricerca è prevalentemente concentrata (e lo sarà anche nel prossimo futuro) al controllo del differenziamento allo scopo di generare i fenotipi cellulari desiderati.
E’ da tenere presente che ogni linea cellulare non varia solo a livello genetico, ma anche immunologico. In un futuro è auspicabile l’impiego di cellule staminali autologhe (sia di origine somatica, sia derivanti da trasferimento nucleare o riprogrammazione indotta), ovvero derivate dal paziente ricevente, onde evitare qualsiasi problema di immunocompatibilità. Tale circostanza è, tuttavia, lontana dall’applicazione immediata sia in termini di risorse economiche necessarie sia in termini requisiti tecnici. Nella prospettiva di impiegare cellule staminali allogeniche nel campo della medicina rigenerativa, le cellule staminali mesenchimali presentano notevoli vantaggi legati alla loro bassa immunogenicità. Tali cellule sono, infatti, caratterizzate da una ridotta espressione delle molecole del sistema maggiore di immunoistocompatibilità (o MHC, molecola responsabile dell’attivazione della risposta linfocitaria T) e non inducono proliferazione di linfociti e cellule presentanti l’antigene, ma, al contrario, hanno un effetto tollerogenico, in quanto prive di molecole costimolatorie.
Accanto a queste caratteristiche intrinseche alle cellule, è necessario tenere in considerazione le diverse condizioni sperimentali di isolamento e coltura che ogni laboratorio di ricerca inevitabilmente presenta, che quindi possono influenzare le linee cellulari derivate (Stojkovic et al., 2004). Infine, sebbene ad oggi esistano alcuni trials clinici sull’uomo, la maggior parte delle ricerche è ancora sviluppata su modelli animali.
Trapianto di derivati cellulari da ESCs
In un organismo adulto, non esistendo la possibilità di “controllare” i segnali cellulari che controllano il differenziamento delle ESCs in situ, è necessario trapiantare cellule già differenziate nel fenotipo d’interesse.
Tali derivati sono differenziati attraverso processi stocastici (formazione di EBs) o attraverso processi di differenziamento diretto in precursori cellulari, in risposta ai segnali dei tessuti circostanti.
Il vantaggio principale nell’utilizzo delle ESCs come fonte di precursori cellulari o cellule differenziate è costituito dalla capacità replicativa e la plasticità che le caratterizza, che tradotto in termini pratici equivale alla disponibilità potenziale di tutti i tipi cellulari nelle quantità desiderate. Un ulteriore vantaggio è rappresentato dalla mancanza di potenziali effetti negativi legati all’età cellulare (associati invece all’impiego di cellule staminali adulte).
Le ESCs, tuttavia, presentano anche vari svantaggi, tra cui:
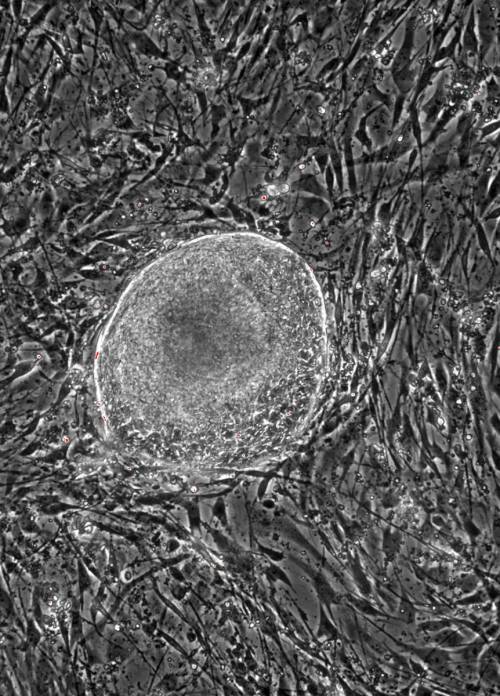
· L’impiego, come gold standard di coltura, di fibroblasti animali (Figura 5) e il conseguente rischio di contaminazioni con elementi non-umani;
· Il rischio di sviluppare teratocarcinomi nel caso la popolazione cellulare trapiantata non sia completamente priva di ESCs allo stato indifferenziato;
· Instabilità epigenetica delle cellule differenziate in vitro;
· Rischio di rigetto delle cellule trapiantate (al di fuori di organi privilegiati a livello immunologico, come il cervello).
Quest’ultimo punto è potenzialmente risolvibile dall’impiego di ESCs ottenute attraverso trasferimento nucleare, nell’ottica di una futuribile terapia cellulare personalizzata.
Trapianto di cellule staminali adulte
Le cellule staminali somatiche sono state usate in trapianti di midollo osseo e sono, attualmente, impiegate in una varietà di condizioni patologiche, tra cui l’infarto del miocardio e il diabete (Fodor, 2003). In particolare, cellule fetali neurali, popolazione cellulare mista composta da Neural Stem Cells (NSCs), precursori neurali e gliali e cellule terminalmente differenziate, sono state impiegate con successo per alleviare i sintomi di malattie neurodegenerative quali Parkinson e Huntington (Stocum, 2001). Popolazioni purificate di NSCs, in questo contesto, non sono state ancora testate.
In un altro caso, cardiomiociti fetali, trapiantati in modelli animali di danno ventricolare, si sono integrati nel muscolo cardiaco dell’ospite, differenziandosi in dischi intercalari (Stocum, 2001).
Trapianti allogenici di midollo osseo sono utilizzati da molti anni per ripopolare il sistema emopoietico di pazienti soggetti a radio- o chemioterapia, affetti da immunodeficienza genetica o disordini metabolici. Uno dei problemi maggiori riguardo a tali approcci terapeutici, consiste nell’immunocompatibilità del tessuto trapiantato, con un alto rischio di sviluppare la malattia graft vs host disease. E’ stato riscontrato, più recentemente, che il sangue cordonale contiene alte concentrazioni di Cellule Staminali Emopoietiche (Haematopoietic Stem Cells - HSCs) dotate di pari efficacia, nel ripopolare il sistema emopoietico del paziente ospite, a quelle isolate da midollo osseo e con un minore rischio di patologie da rigetto (Stocum, 2001).
Uno degli interrogativi più grandi nel campo delle staminali dell’adulto è rappresentato dalla limitata capacità d’espansione di tali cellule: questa nozione è vera, tuttavia, solo per le cellule staminali di quei tessuti che si rigenerano naturalmente. In presenza di tessuti con scarsa capacità rigenerativa, sebbene se ne possano isolare le staminali, è necessario essere a conoscenza dell’attività genica che contraddistingue la rigenerazione dalla cicatrizzazione, allo scopo di inattivare molecole inibitorie o, al contrario, attivare molecole stimolanti la prima, nel sito di lesione. E’ necessario, inoltre, che tali informazioni siano associate ad altre, che spieghino i processi di patterning e morfogenesi intrapresi dalle cellule in differenziamento.
Conclusioni
Trent’anni dopo l’isolamento delle prime ESCs murine e dieci anni dopo l’isolamento delle ESCs umane, è evidente che alcune delle sottopopolazioni di cellule staminali derivate dall’embrione sono plastiche in quanto possono essere manipolate e convertite le une nelle altre.
Meritano di essere sottolineati, in particolare, tre risultati:
1. L’esistenza di linee staminali derivate da embrioni di topo e ratto che rispettano la definizione di cellula staminale embrionale (autorinnovamento, pluripotenza e abilità di differenziarsi in senso germinale).
2. La consapevolezza che le ESC murine e umane rappresentano in realtà diversi stadi embrionali, piuttosto che variabilità interspecie.
3. Cellule staminali pluripotenti possono essere isolate da tessuti post-natali, ma potrebbero non esistere in vivo o, nel caso contrario, non necessariamente essere coinvolte nel normale sviluppo o turnover tissutale (Slack, 2008).
La ricerca sulla biologia e sulla medicina rigenerativa sta avanzando velocemente in molti laboratori in tutto il mondo ed è necessario pensare alla rigenerazione in termini di attivazione di un processo funzionale da parte di cellule, a diversi stati di differenziamento, in risposta ad una lesione. Benché esistano varie sfide concettuali e tecniche da superare, al momento sono in corso studi per elaborare terapie efficaci.
Bisogna, tuttavia, considerare che esistono alcuni punti critici da risolvere quali:
1. Determinare un pannello di marcatori unici che possa essere impiegato per identificare e purificare le cellule staminali dell’adulto per particolari popolazioni cellulari differenziate. E’ da tenere presente che i profili di espressione genica e la presenza di marcatori di superficie, comunemente usati per descrivere un fenotipo cellulare differenziato, possono essere valutazioni non-definitive e soprattutto non univoche.
2. Capire e determinare come propagare facilmente le ESCs in uno stato indifferenziato e quali combinazioni di segnali chimici e fisici possano dirigerne la differenziazione in vitro verso tutti i precursori o i fenotipi terminali desiderati.
Quest’ultimo punto è forse il più complicato in quanto, ancora oggi, la conoscenza in merito al differenziamento delle staminali è ancora molto scarsa, anche in considerazione del fatto che le cellule staminali tendono a formare popolazioni eterogenee nella maggior parte dei protocolli di differenziazione.
E’ chiaro che, a fini terapeutici, il rigoroso controllo del processo di differenziazione verso un tipo cellulare specifico, la generazione di popolazioni cellulari omogenee e la corretta caratterizzazione delle cellule ottenute sono punti fondamentali per la realizzazione dei quali saranno necessari sforzi scientifici e tecnologici.
Molti protocolli di differenziamento prevedono la formazione in modo graduale di cellule progenitrici. La caratterizzazione e la comprensione di popolazioni miste di cellule progenitrici saranno, quindi, di notevole importanza nella ricerca sulle cellule staminali, anche nel caso in cui queste problematiche vengano superate.
Sarà, certamente, necessario stabilire rigorose linee guida per accertare sia la qualità sia la specificità di differenziamento delle cellule staminali, con la consapevolezza che la terapia con cellule staminali ha davanti ancora molti ostacoli da superare prima che diventi un’opzione terapeutica possibile e ampiamente utilizzata.
Bibliografia
1.
Alison MR, Poulson R, Otto WR, Vig P, Brittan M, Direkze NC, Lovell M, Fang TC, Preston SL, Wright NA (2004) “Recipes for adult stem cell plasticity: fusion cuisine or readymade?” J Clin Pathol; 57: 113-20.
2.
Binas B. (2009) “Embryo-derived stem cells -a system is emerging” BMB Rep; 42(2): 72-80.
3. Blau HM, Brazelton TR and Weimann JM (2001) “The Evolving Concept of a Stem Cell: Entity or Function?” Cell; 105: 829-841.
4.
Carpenter MK, Rosler ES, Fisk GJ, Brandenberger R, Ares X, Miura T, Lucero M and Rao MS (2004) “Properties of Four Human Embryonic Stem Cell Lines Maintained in a Feeder-Free Culture System” Dev Dyn 229: 243–258.
5.
Cedar SH, Cooke JA, Patel MR, Luo Z and Minger SL (2007) “The therapeutic potential of human embryonic stem cells” Indian J Med Res 125: 17-24.
6.
Fodor WL (2003) “Tissue engineering and cell based therapies, from the bench to the clinic: The potential to replace, repair and regenerate” Reprod BiolEndocrinol 1: 102-122.
7.
Hipp J and Atala A. (2008) “Sources of Stem Cells for Regenerative Medicine” Stem Cell Rev; 4:3–11.
8.
Pittenger MF, Mackay AM, Beck SC Jaiswal RK, Douglas R, Mosca JD, Moorman MA,
9.
Shah NM, Groves AK, Anderson DJ. (1996) “Alternative neural crest cell fates are instructively promoted by TGFß superfamily members” Cell; 85: 331–343.
10.
Slack JMW (2008) “Origin of Stem Cells in Organogenesis” Science; 322: 1498-1501.
11.
Stocum DL (2001) “Stem cells in regenerative biology and medicine” Wound Repair Regen; 9: 429-442.
12.
Stojkovic M, Lako M, Strachan T, Murdoch A. (2004) “Derivation, growth and applications of human embryonic stem cells” Reproduction; 128 : 259-67.
13.
Takahashi K and Yamanaka S. (2006) “Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors” Cell; 126: 663-676.
14.
Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K and Yamanaka S (2007) “Induction of pluripotent stem cells from adult human fibroblasts by defined factors” Cell; 131: 861-872.
15.
Turnpenny L, Spalluto CM, Perrett RM, O’Shea M, Hanley KP, Cameron IT, Wilson DI and Hanley NA (2006) “Evaluating Human Embryonic Germ Cells: concord and conflict as pluripotent stem cells” Stem Cells; 24: 212-220.
16.
Weissmann IL (2000) “Stem Cells: Units of Development, Units of Regeneration, and Units in Evolution” Cell; 100: 157–168.
___________________
Didascalie
Figura 1
Sviluppo dell’embrione pre-impianto: per ogni stadio sono indicati alcuni marcatori molecolari specifici.
Figura 2
Caratteristiche di plasticità in relazione allo stadio di sviluppo (ICM = Inner Cell Mass).
Figura 3
Esempio di Corpo Embrioide in coltura (eseguito presso il Laboratorio di Cellule Staminali, S.I.S.Me.R – Bologna)
Figura 4
Esempi di meccanismi regolatori del differenziamento delle staminali embrionali. A) L’aumento dell’espressione di CDX2 e la riduzione di OCT4 inducono le hESCs a differenziarsi in trofoblasto. B) Formazione dell’Endoderma Extraembrionale o dell’Epiblasto a seguito della riduzione / aumento dell’espressione di NANOG e GATA-6.
Figura 5
Esempio di colonia di hESCs cresciuta su fibroblasti embrionali murini (eseguito presso il Laboratorio di Cellule Staminali, S.I.S.Me.R – Bologna)

